Nguyên tố Nitơ ở ô thứ 7 thuộc chu kỳ 2 nhóm VA trong bảng tuần hoàn, Nitơ N2 là chất khí, không màu, không mùi, không vị và được ứng dụng khá nhiều trong đời sống để sản xuất phân đạm, axit nitric và đặc biệt là công nghiệp luyện kim và bảo quản mẫu phẩm sinh học,…Vậy Nitơ ( N ) có mấy hóa trị, tính chất hóa học ra sao và cấu tạo phân tử như thế nào thì ở bài viết dưới đây chúng ta cùng nhau đi tìm hiểu rõ nguyên tố này nhé.
Định nghĩa Nitơ là gì?
Để trả lời cho câu hỏi “Nitơ là gì?” chúng ta cần phải biết được cấu trúc cũng như thành phần cấu tạo nên một nguyên tử nitơ. Chất này ở vị trí thứ 7, chu kì 2 và nhóm VA trong bảng tuần hoàn hóa học. Điều đó có nghĩa là nguyên tố này có cấu trúc electron gồm 2 lớp, lớp ngoài cùng vỏ có 5 electron hoạt động. Vì vậy mà Nitơ được coi như một phi kim hoạt động mạnh, ở hầu hết các hợp chất thì nguyên tử này mang hóa trị 3.

Vị trí và cấu hình electron nguyên tử
Nitơ ở ô thứ 7, nhóm VA, chu kì 2 của bảng tuần hoàn.
Cấu hình electron nguyên tử của nitơ là 1s22s22p3.
Ba electron ở phân lớp 2p có thể tạo được ba liên kết cộng hóa trị với các nguyên tử khác.
Cấu tạo phân tử của Nitơ
– Phân tử Nitơ gồm 2 nguyên tử, giữa chúng hình thành 1 liên kết 3: (N≡N) cấu tạo phân tử nitơ
- Hidro (H) hóa trị mấy? Nguyên tử khối và tính chất hóa học
- C CO2 Phương trình hóa học Cacbon tác dụng với Cacbon Dioxit.
– Trong các hợp chất, các nguyên tố nhóm nitơ có mức oxi hóa cao nhất là +5, ngoài ra còn có các mức -3 và +3. Riêng N còn có thêm các mức oxi hóa +1, +2 và +4.
– Nitơ có hóa trị : II, III, IV
Tính chất của Nitơ :
Tính chất vật lý
Nitơ là một chất khí không màu, không mùi, không vị và có khối lượng nhẹ hơn không khí N2=28, còn gọi là đạm khí.
Chất này tan ít trong nước và có nhiệt độ hóa lỏng ở – 196oC và nhiệt độ hóa rắn cũng rất thấp. (Nitơ lỏng là gì? – đây là một dạng hợp chất giống nước nhưng chỉ có 80,8% nitơ ở điểm sôi, có hằng số điện môi là 1,4 và được viết tắt là “LIN” hay “LN”)
Dù là thành phần chiếm 4/5 trong không khí những khí này không có khả năng duy trì sự cháy và sự sống.
Là thành phần cấu tạo nên nhiều hợp chất quan trọng trong đời sống như axit amin, amoniac, axit nitric,… Thành phần này có mặt trong hầu hết các cơ thể sống của sinh vật bao gồm cả con người.
Tính chất hoá học của Nitơ
– Các mức oxi hóa mà Nitơ (N) có thể có là: -3, 0, +1, +2, +3, +4, +5.
– Vì phân tử chứa liên kết ba rất bền vững nên ở điều kiện thường, nitơ là một chất ít hoạt động chỉ tham gia phản ứng ở nhiệt độ cao. Nitơ vừa là chất khử vừa là chất oxi hóa.
1. Nitơ là chất oxi hóa
a) Nitơ tác dụng với kim loại → Muối Nitrua.
– PTPƯ: N2 + Kim loại → Muối Nitrua
+ Nhiệt độ thường chỉ tác dụng với Li:
6Li + N2 → 2Li3N
+ Nhiệt độ cao phản ứng với một số kim loại như Mg, Ca và Al,…
2Al + N2 → 2AlN
3Ca + N2 → Ca3N2
b) Nitơ tác dụng với H2 → Amoniac
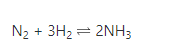
– Phản ứng này xảy ra trong điều kiện nhiệt độ > 4000C; áp suất p và xúc tác Fe.
2. Nitơ là chất khử (N2 + O2)
– Phản ứng của Nitơ với Oxi xảy ra ở nhiệt độ 30000C hoặc trong lò hồ quang điện
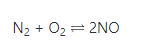
– Khí NO không màu hoá nâu trong không khí do phản ứng:
2NO không màu + O2 → 2NO2 (màu nâu đỏ)
Điều chế
1. Trong công nghiệp
Nitơ được sản xuất bằng phương pháp chưng cất phân đoạn không khí lỏng. Sau khi đã loại bỏ CO2 và hơi nước, không khí được hóa lỏng dưới áp suất cao và nhiệt độ rất thấp. Nâng nhiệt độ không khí lỏng đến -196 oC thì nitơ sôi và được lấy ra, còn lại là oxi lỏng, vì oxi lỏng có nhiệt độ sôi cao hơn (-183 oC). Khí nitơ được vận chuyển trong các bình thép, nén dưới áp suất 150 atm.
2. Trong phòng thí nghiệm
Một lượng nhỏ nitơ tinh khiết được điều chế bằng cách đun nóng nhẹ dung dịch bão hoà muối amoni nitrit:
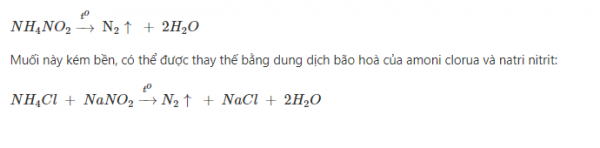
Trạng thái tự nhiên
Trong tự nhiên, nitơ tồn tại ở dạng tự do (chiếm 78,16% thể tích của không khí) và dạng hợp chất. Nitơ thiên nhiên là hỗn hợp của hai đồng vị: 147N (99,63%) và 157N (0,37%).
Ở dạng hợp chất, nitơ có nhiều trong khoáng chất natri nitrat NaNO3, với tên gọi là diêm tiêu natri.
Ứng dụng
Nguyên tố nitơ là một trong những thành phần dinh dưỡng chính của thực vật.
Trong công nghiệp, phần lớn lượng nitơ sản xuất ra được dùng để tổng hợp khí amoniac, từ đó sản xuất ra axit nitric, phân đạm, …

Nhiều ngành công nghiệp như luyện kim, thực phẩm, điện tử, … sử dụng nitơ làm môi trường trơ. Nitơ lỏng được dùng để bảo quản máu và các mẫu vật sinh học khác.
Xem thêm tại đây :
Bảng Hóa Trị Lớp 8, Cách Học Thuộc Bằng Bài Ca Hóa Trị Hóa Học.
Hóa trị của Cacbon là mấy ( C ), Nguyên tử khối và cách điều chế chuẩn
Hóa trị của nguyên tố Bo ( B ), Tính chất và vai trò của nguyên tố B
Hóa trị của Beri ( Be), Tính chất và hợp chất chuẩn của Be
Hóa trị của liti ( Li ), tính chất hóa học và khối lượng nguyên tử
